Saiba o que estudar para o vestibular do Mackenzie!
A tabela periódica é um instrumento fundamental para o aprendizado e o desenvolvimento da química. Nela, estão contidos todos os 118 elementos conhecidos, organizados por características comuns e em ordem crescente de acordo com seu número atômico.
As primeiras tabelas periódicas como conhecemos foram organizadas pelo russo Dmitri Mendeleyev e pelo alemão Julius Lothar Meyer, no século XIX. O conceito foi sendo desenvolvido até chegar ao modelo de hoje, com sete linhas horizontais e 18 linhas verticais.
O que é tabela periódica?
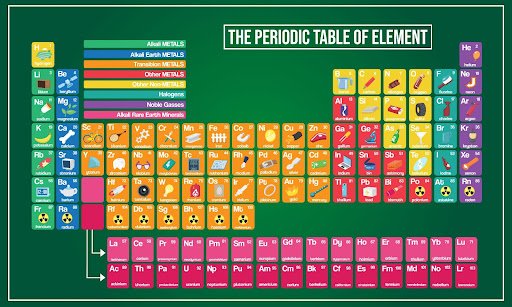
A tabela periódica é um arranjo de todos os elementos conhecidos pelo ser humano de acordo com seu número atômico crescente e propriedades químicas semelhantes. É chamada de periódica devido à forma como os elementos são organizados. Eles são classificados em um arranjo tabular em que uma linha é um período e uma coluna é um grupo.
Os elementos são organizados da esquerda para a direita e de cima para baixo na ordem de seus números atômicos crescentes. Assim, elementos no mesmo grupo terão a mesma configuração de elétrons de valência e, portanto, propriedades químicas semelhantes.
Os primeiros 94 elementos da tabela periódica ocorrem naturalmente, enquanto o restante, de 95 a 118, só foram produzidos em laboratórios ou em reatores nucleares pelos cientistas.
Para que serve a tabela periódica?

Tudo que existe no universo, inclusive os próprios seres humanos, é constituído por elementos químicos. Por isso, é muito importante compreender quais são suas propriedades e características. Quando Mendeleyev e Meyer organizaram os elementos em uma tabela, eles ajudaram os cientistas a compreender melhor sua interrelação.
A tabela periódica significa que os cientistas podem prever as propriedades da matéria na Terra e no resto do Universo. Sua criação foi descrita como “uma das conquistas mais significativas da ciência” pelas Nações Unidas, quando decidiu transformar 2019 no ano internacional da tabela periódica de elementos químicos.
Quais são as famílias dos elementos químicos?

As propriedades de um elemento são devidas à distribuição de elétrons ao redor do núcleo do átomo, particularmente os elétrons externos ou de valência; são esses elétrons que estão envolvidos nas reações químicas.
1. Metais alcalinos

Todos os elementos do grupo 1, com exceção do hidrogênio, são extremamente reativos e, por isso, costumam ser encontrados em compostos. Fisicamente, a família dos metais alcalinos é prateada, branca e clara. Eles também têm baixo ponto de fusão e baixo ponto de ebulição.
2. Metais alcalinos terrosos

Os elementos da segunda família mais reativa na tabela periódica são fortes agentes redutores, bons condutores térmicos e elétricos. Fisicamente, eles têm baixa densidade, baixo ponto de fusão e baixo ponto de ebulição.
3. Metais de transição

Os elementos dos grupos 3 a 11 têm baixas energias de ionização e alta condutividade. Além disso, eles têm altos pontos de fusão, altos pontos de ebulição e alta condutividade. Fisicamente, eles são metálicos e maleáveis.
4. Família do Boro

São caracterizados como um grupo por terem três elétrons nas partes mais externas de sua estrutura atômica. O boro, o mais leve desses elementos, é um semimetal, enquanto alumínio, gálio, índio e tálio são metais brancos prateados.
5. Família do Carbono
Exceto para o germânio e o flerovium produzido artificialmente, todos esses elementos com camada de valência de 4 elétrons são familiares na vida diária, seja como o elemento puro, seja na forma de compostos, embora, exceto o silício, nenhum seja particularmente abundante na crosta terrestre.
6. Família do Nitrogênio

Com uma configuração eletrônica da camada de valência com 5 elétrons, o grupo reúne ametais, como nitrogênio e o fósforo, e o semimetal arsênio, sendo os demais elementos metais.
7. Calcogênios

Caracterizados por uma camada de valência com 6 elétrons, todos os elementos são não metais. O nome calcogênio é a junção da palavra grega Khaltos (que quer dizer cobre) com o termo genos e significa “origem nobre”.
8. Halogênios

A única família periódica que contém elementos nos três estados da matéria na temperatura padrão. Eles são não metais altamente reativos, altamente eletronegativos e altamente tóxicos.
9. Gases Nobres
Gases inertes que podem ser encontrados no grupo 18 da tabela periódica. São estáveis e relativamente não reativos. Além disso, eles têm baixos pontos de ebulição e baixos pontos de fusão. Fisicamente, são incolores e não têm cheiro.
Fonte: Toda Matéria, Universidade Federal de Lavras (Ufla).